Dalam ilmu kimia, ada salah satu campuran yang diberi nama sebagai larutan. Setiap jenis larutan memiliki sifat koligatif larutan yang berbeda-beda karena adanya perbedaan konsentrasi dan bahan campurannya. Adanya reaksi koligatif disebabkan oleh prosesnya yang membuat larutan memiliki fungsi tertentu sebagai hasil akhirnya.
Sifat yang satu ini memiliki perbedaan antara satu dengan yang lainnya dan terdapat empat jenis larutan berdasarkan konsentrasinya. Sifat koligatif juga bisa ditemukan dalam kehidupan sehari-hari, bahkan ketika kamu memasak. Berikut ini merupakan pembahasan yang lengkap tentang sifat, pengertian, dan informasi penting lain terkait koligatif larutan.
Pengertian Sifat Koligatif Larutan
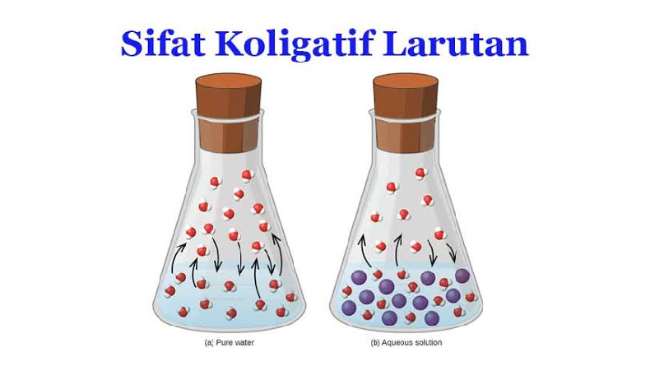
Definisi dari sifat koligatif larutan adalah sebuah larutan yang memiliki zat tertentu, namun hasil akhir larutannya tergantung pada jumlah partikel di dalamnya. Di sisi lain, larutan juga tidak bergantung pada jenis zatnya sama sekali. Hukum yang membahas tentang koligatif larutan yakni hukum Raoult. Koligatif memiliki persamaan makna seperti kolektif.
Peran yang penting dalam sifat koligatif larutan adalah peran dari jumlah partikel itu sendiri. Apabila jumlahnya semakin besar, maka semakin tinggi tingkat koligatifnya. Meski begitu definisi ini terlepas dari keadaan atau bentuk partikel yang ada di dalam zat itu sendiri. Sifat ini berhubungan dengan kuantitas zat dalam larutan, bukan kualitasnya.
Pengertian sifat koligatif juga dibatasi oleh dua asumsi. Asumsi yang pertama, larutan bukanlah tipe larutan yang mudah menguap karena prosesnya bisa mempengaruhi konsentrasi. Yang kedua, zat di dalam larutan juga bukanlah materi yang mudah larut di dalam bentuk zat yang padat. Barulah sifat koligatif akan berlaku.
Sifat Koligatif Larutan

1. Penurunan Tekanan Uap
Peristiwa penguapan disebabkan oleh lemahnya gaya tarik menarik yang terjadi antar molekul. Zat yang memiliki kemungkinan besar adalah zat cair. Ketika zat cair menguap, maka tekanan uap jenuhnya memiliki nilai yang lebih besar. Meski begitu, uap yang ada di udara dan meninggalkan kelompoknya akan kembali menjadi partikel cair.
Sifat yang terjadi dalam koligatif larutan ini terjadi karena adanya beberapa faktor utama. Selain karena adanya pengaruh suhu, jumlah partikel zat juga berpengaruh. Itu sebabnya air dan bensin akan menguap lebih cepat daripada susu dan cat. Susu dan zat memiliki kuantitas zat campuran pada larutan yang lebih banyak daripada air dan bensin.
- Konsep penurunan tekanan uap
Konsep koligatif larutan pada sifat yang satu ini memiliki peranan penting dalam berbagai peristiwa yang berhubungan dengan termodinamika. Setiap larutan yang memiliki zat berbeda akan memiliki titik didih yang berbeda, begitu juga dengan laju penguapannya yang merujuk pada penurunan tekanan uap.
- Rumus penurunan tekanan uap
Untuk menghitung penurunan tekanan uap, maka kamu harus menggunakan hukum Raoult. Prinsip dasarnya adalah besar tekanan uap pada larutan akan berbanding lurus dengan fraksi mol pelarut. Rumus yang digunakan adalah:
∆P = P° . Xp
di mana
P° – P = (1 – Xp)
P° P° – P = P° – Xp . P°
Keterangan:
∆P = penurunan tekanan uap (mmHg)
Xp = fraksi mol dalam pelarut
P° = tekanan uap jenuh dalam pelarut murni (mmHg)
P = tekanan uap larutan (mmHg)
2. Tekanan Osmotik
Tekanan osmotik merupakan sebuah proses yang terjadi di dalam peristiwa sifat koligatif larutan. Perpindahan ini terjadi antara larutan, di mana molekul pelarut berpindah dari pelarut encer ke pekat. Peristiwa ini juga berlaku untuk larutan murni ke larutan campuran melalui sebuah selaput yang disebut sebagai selaput semipermeabel.
Tekanan osmotik akan selalu mencari kesetimbangan di antara dua larutan yang mengalami perpindahan zat terlarut tersebut. Nantinya, larutan-larutan akan memiliki jumlah kandungan isotonis yang sama. Setelah sama, peristiwa tekanan osmotik akan berhenti. Sebelum seimbang, maka peristiwa akan terus berlangsung.
Istilah dalam tekanan osmotik adalah hipertonik dan hipotonik. Hipertonik adalah istilah yang mengacu kepada larutan dengan konsentrasi tinggi. Sementara hipotonik adalah larutan berkonsentrasi rendah. Saat larutan memiliki keseimbangan yang sama, maka namanya adalah larutan isotonik.
Menghitung tekanan osmotik menggunakan prinsip rumus sebagai berikut:
∏ . V = n R T
Keterangan:
∏ = tekanan osmotik (Pa atau atm)
V = volume larutan (dm³ atau L)
n = mol zat yang terlarut
R = 0.082 L atm/mol
T = suhu
3. Kenaikan titik didih
Apa yang terjadi saat kamu memasak air pada suhu yang konstan dalam periode yang cukup lama? Air akan mendidih dan suhu yang kamu hitung mengalami titik yang tetap. Saat air dimasak dan mendidih, kamu akan menemukan bahwa suhunya akan tetap 100°C. Karena tidak naik, maka air akan berubah menjadi uap.
Hal ini disebabkan oleh tekanan uap yang diberikan oleh air mendidih menjadi sama dengan tekanan udara yang ada di sekitar. Peristiwa ini bisa disebut sebagai kenaikan titik didih. Nilainya akan selalu lebih dari titik didih pelarut murni karena zatnya menguap dan menghilangkan partikel di dalam larutan.
- Konsep kenaikan titik didih
Menguapnya partikel dalam larutan akibat titik didih memaksa pelepasan energi yang sangat besar ke udara. Pelepasan energi akan berhenti manakala air yang menguap sudah habis dan tidak ada lagi partikel yang perlu diuapkan. Lambang dari titik didih adalah ∆Tb dengan perhitungan rumus yang sederhana.
- Rumus kenaikan titik didih
Perhitungan kenaikan titik didih sangat mudah dan harus disesuaikan dengan partikel dalam pelarut dan titik didih dari larutan. Kamu bisa menghitungnya dengan rumus:
∆Tb = Tb larutan – Tb pelarut
Keterangan:
∆Tb = kenaikan titik didih
Tb larutan = titik didih larutan (dalam °C)
Tb pelarut = titik didih pelarut (dalam °C)
Kenaikan titik didih memegang prinsip bahwa semakin banyaknya partikelnya, makin tinggi pula kenaikan titik didihnya. Jadi, kamu mungkin perlu menggunakan rumus lain apabila yang diketahui adalah molalitas pelarutnya dengan memakai rumus ini:
∆Tb = m x Kb
Keterangan:
∆Tb = kenaikan titik didih
m = molalitas larutan
Kb= besaran kenaikan titik didih (°C/mol)
4. Penurunan titik beku
Penurunan titik beku memiliki lambang ∆Tf yang merupakan suhu dari tekanan uap. Suhu ini memiliki nilai yang sama dengan uap padatan dan terjadi ketika air mulai membeku. Sementara standar penentuan titik beku menggunakan suhu saat membeku atau meleleh ketika berada di dalam tekanan 1 atm.
- Konsep penurunan titik beku
Pada saat sebuah larutan yang mulai membeku ditambahkan bahan zat terlarutnya, maka titik beku akan semakin menurun. Hal ini disebabkan oleh air yang kesulitan untuk mendominasi larutan karena partikel terlarut semakin banyak. Perubahan dalam proses meleleh pun menjadi terganggu.
Nilai sebuah hasil penurunan titik beku akan selalu lebih rendah daripada titik beku dari pelarut murni, dalam hal ini titik beku air. Ketika kamu menambahkan zat air ke larutan, maka yang terjadi adalah kenaikan suhu dan proses mencair malah lebih cepat.
- Rumus penurunan titik beku
∆Tf = Tf pelarut – Tf larutan
Keterangan:
∆Tf = penurunan titik beku.
Tf pelarut = suhu titik beku pelarut (dalam °C).
Tf larutan = suhu titik beku larutan (dalam °C).
Kamu juga bisa menggunakan rumus lain apabila sudah mengetahui molalitas dari zat pelarut dan larutannya. Rumus yang digunakan adalah:
∆Tf = m x Kf
Keterangan:
∆Tb = penurunan titik beku
m = molalitas larutan
Kb= besaran penurunan titik beku (°C/molal)
Istilah dalam Sifat Koligatif Larutan
1. Molaritas
Ketika mempelajari sifat koligatif larutan, kamu akan sering mendengar istilah molaritas. Molaritas adalah sebuah ukuran zat yang larut di dalam sebuah zat pelarut. Satuan ukur untuk melambangkan molaritas adalah mol/L. Perhitungannya akan selalu melihat kuantitas zat di dalam satu liter larutan.
Apabila sebuah zat memiliki nilai 32 mol, artinya di dalam satu liter larutan, konsentrasinya adalah 32 mol/L. Perhitungan ini sangat penting dalam kimia karena akan mempengaruhi kepekatan sebuah larutan. Nilai mol dari sebuah partikel akan berbeda-beda dan akan tergantung dari zat pelarutnya pula.
Konsep molaritas bisa terbilang unik karena faktor perubahannya cukup rumit, terdiri dari tekanan, volume zat, dan suhu. Apabila terjadi kenaikan suhu dan tekanan yang signifikan, nilai mol akan jauh berkurang di dalam larutan tersebut. Untuk menyatakan molaritas, lambang yang digunakan adalah (M).
2. Molalitas
Apabila kamu ingin menghitung banyaknya sebuah zat yang cenderung berubah karena adanya suhu dan tekanan, maka satuan yang perlu digunakan adalah molalitas. Molalitas fokus kepada jumlah zatnya, bukan dari banyaknya zat yang melarutkan zat yang terlarut. Lambang molalitas adalah (m).
Molalitas merupakan sebuah bagian penting untuk menentukan titik didih, titik beku, kenaikan titik didih, dan penurunan titik beku. Rumus-rumus dalam sifat koligatif larutan menggunakan molalitas sebagai bagian dalam perhitungan. Semakin banyak zat dalam larutan, maka nilai molalitas juga akan semakin tinggi.
3. Fraksi mol
Sama seperti molaritas dan molalitas, bagian ini pun penting untuk sifat koligatif. Hanya saja, fungsinya adalah membandingkan zat yang terlarut dan pelarut dengan semua nilai mol yang ada. Fraksi mol jarang digunakan kecuali ketika kamu butuh mengetahui semua nilai dalam sebuah larutan.
Manfaat Sifat Koligatif Larutan
Membuat minyak kelapa
Pembuatan minyak kelapa dilakukan dengan sangat hati-hati karena minyak ini mudah sekali membeku. Penentuan titik bekunya memanfaatkan prinsip sifat koligatif yang ada pada larutan, sehingga bisa lebih awet dan tidak mudah membeku atau memutih.
Memasak
Pernahkah kamu memberikan garam pada masakan? Prinsip ini juga bagian dari koligatif larutan. Semakin banyak zat yang digunakan dalam sebuah volume, maka jumlah zat garam juga mempengaruhi masakan. Contoh ini adalah bagian dari tekanan osmosis.
Membuat es putar
Pedagang es putat membuat siasat agar es di dalam pancinya tetap awet. Area di sekitar panci tidak hanya berupa es batu saja, namun juga diberi taburan garam. Tujuannya adalah agar es tidak mudah cair dan titik bekunya selalu tetap.
Prinsip air dalam tumbuhan
Tumbuhan tidak akan hidup tanpa adanya air. Prinsip koligatif ini berlaku karena akar tanaman menyerap air dari tanah melalui akar. Kemudian dengan sifat osmosis, akar menyebarkan ke bagian pohon lainnya.
Sifat koligatif larutan merupakan hal penting yang dipelajari dalam pelajaran kimia. Banyak kejadian sehari-hari yang berkaitan dengan materi ini. Sifat-sifat di atas akan memudahkan kamu untuk memahami koligatif larutan dan memahami materi molaritas dan molalitas lebih baik.
Baca Juga: